Ammoniak
aus Wikipedia, der freien Enzyklopädie
Ammoniak (nach dem Ammonssalz [NH4Cl = Ammoniumchlorid] aus der Ammonsoase, heute Oase Siwa) ist ein äußerst stark stechend riechendes, farbloses Gas, das zu Tränen reizt und erstickend wirkt.
| Strukturformel | |||||
|---|---|---|---|---|---|
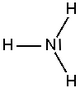 |
|||||
| Allgemeines | |||||
| Name | Ammoniak | ||||
| Summenformel | NH3 | ||||
| Andere Namen | als wässrige Lösung: Salmiakgeist, Ammoniakwasser | ||||
| Kurzbeschreibung | Farbloses Gas. Reizt die Atemwege. | ||||
| CAS-Nummer | 1336-21-6 | ||||
| Sicherheitshinweise | |||||
Lösung >10%
|
|||||
Gas
|
|||||
| R- und S-Sätze | R: 34-50 S: 26-36/37/39-45-61 |
||||
| Handhabung | Handschuhe, Augen- und ggf. Atemschutz | ||||
| Lagerung | unter +25 °C, Ammoniak-Luft-Gemische sind explosionsfähig | ||||
| MAK | 20 ml/m3 | ||||
| LD50 (Ratte, oral) | 350 mg/kg | ||||
| LD50 (Kaninchen) | - | ||||
| Physikalische Eigenschaften | |||||
| Aggregatzustand | gasförmig | ||||
| Farbe | farblos | ||||
| Dichte | 0,771 kg/m³ | ||||
| Molmasse | 17 g/mol | ||||
| Schmelzpunkt | 195,75 K (-77,4 °C) | ||||
| Siedepunkt | 239,75 K (-33,4 °C) | ||||
| Dampfdruck | 8,572 bar (20°C) | ||||
| Weitere Eigenschaften | |||||
| Löslichkeit | - | ||||
| Gut löslich in | Wasser, Alkohole, Benzol, Aceton, Chloroform | ||||
| Schlecht löslich in | - | ||||
| Unlöslich in | - | ||||
| Analytik | |||||
| Klassische Verfahren | Vorsichtige Geruchsprobe reicht meist aus. Geringe Gasmengen können beispielsweise mit angefeuchtetem Indikatorpapier nachgewiesen werden, welches auf die bei der Reaktion von Ammoniak und Wasser entstehenden OH- Ionen mit Färbung reagiert. | ||||
|
SI-Einheiten wurden wo möglich verwendet. Wenn nicht anders vermerkt wurden Normbedingungen benutzt. |
|||||
| Inhaltsverzeichnis [Verbergen] |
Weitere Eigenschaften
- kritische Temperatur: 132,5 °C
- kritischer Druck: etwa 11,3 MPa (Megapascal)
Ammoniak ist sehr gut wasserlöslich, bei 0 °C lösen sich in 100 ml Wasser 90,7 g. Diese Ammoniaklösung heißt Salmiakgeist. Sie reagiert alkalisch (Ammoniumhydroxid).
Ammoniak-Luft-Gemische sind im Bereich von 15,5 bis 30 Vol.-% Ammoniak mit einer Zündquelle ab 630 °C explosionsfähig (Gefahr allerdings eher in geschlossenen Räumen). Diese Zündquelle kann in Großtechnischen Anlagen auch Wasserstoff darstellen, so dass auch unter 630 °C die Möglichkeit einer Explosion besteht. Es verbrennt schnell und vollständig, so dass anschließend kein NH3 mehr wahrnehmbar ist.
Ammoniak wirkt auf Haut und Schleimhäute (insbesondere auch auf die Augen) ätzend. Geschluckt ruft es blutiges Erbrechen mit heftigen Schmerzen und Lungenschäden hervor, unter Umständen mit tödlichem Ausgang. Ein Ammoniakgehalt der Luft von 1,5 bis 2,5 g/m³ wirkt nach 30 bis 60 Minuten tödlich.
Herstellung
Die Herstellung geschieht nach dem Haber-Bosch-Verfahren
Verwendung
Ammoniak ist eines der wichtigsten und häufigsten Produkte der chemischen Industrie. 1992 betrug die Weltproduktion von Ammoniak etwa 90 Millionen Tonnen. Der Großteil dieser Produktion wird als Ausgangstoff für Stickstoffdünger verwendet. Daneben wird:
- flüssiger Ammoniak wegen seiner hohen Verdampfungswärme in Kältemaschinen eingesetzt (Kältemittelbezeichnung R717).
- In der Textilveredlung, zum Plastifizieren von Holz und als nichtwässeriges Lösungsmittel wird Ammoniak gebraucht
- Gasförmiger Ammoniak wird als Destraktions-Mittel und in der Metall-Industrie zur Nitrierhärtung verwendet.
- Ammoniakwasser findet Verwendung zu Reinigungs- und Beizzwecken. Auch wird es zum Unschädlichmachen von Chlor u. Formaldehyd nach Desinfektionsmaßnahmen eingesetzt.
- Ammoniak kann auch zur Entschwefelung und Entstickung von Rauchgas verwendet werden. Hierbei bildet sich Ammoniumsulfat, dass als Düngemittel verwertet wird.
- Ammoniak wird auch zur Herstellung von Arzneimittel und Sprengstoff eingesetzt.
- Ammoniakwasser wird in Chlorgasanlagen zur Dichtigkeitsprüfung eingesetzt. An Lecks kommt es zur Nebelbildung, aufgrund entstehenden Ammoniumchlorids [NH4Cl]
- erlangt in flüssiger und überkritischer Form immer mehr Bedeutung als nicht oxidatives Lösemittel, unter anderem wegen seiner physikalisch-chemischen Ähnlichkeit zu Wasser (Wasserstoffbrückenbindungen, Eigendissoziation NH4+ + NH2- -> NH3, usw.)
- Ammoniak ist eine der bedeutendsten Grundchemikalien der chemischen Industrie. Aus ihm werden zahlreiche weitere Vorprodukte hergestellt. Hierbei sind besonders zu nennen:
Ammoniak
____|_____________________________________
| | |
Oxidation | | sämtlicher
| (NH2)2CO (Harnstoff) weiterer
| / | organischer
Salpetersäure Kunstharze | und
/ / | \ Düngemittel anorganischer
Nitrate / | \ Stickstoff
/ | \ / / | \
Düngemittel | \ Hydroxylamin / | Nitrile
| \ / |
Adipinsäure Nitroaromaten Amine Hydrazin
beispielsweise Anilin
Literatur
- Robert Schlögl: Katalytische Ammoniaksynthese - eine "unendliche Geschichte"? Angewandte Chemie 115(18), S. 2050 - 2055 (2003), ISSN 0044-8249
Weblinks
- http://www.m-ww.de/pharmakologie/giftstoffe/ammoniak.html
Dieser Artikel basiert auf dem Artikel Ammoniak aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar.


