Lysin
aus Wikipedia, der freien Enzyklopädie
Lysin (2,6-Diaminohexansäure) gehört zu den 20 proteinogenen (eiweißbildenden) Aminosäuren, die für die Verwendung bei der Proteinbiosynthese im Grundstoffwechsel der Organismen durch ein Basentriplett der RNA codiert wird.
| Strukturformel der Aminosäure | |
|---|---|
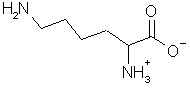 |
|
| Allgemeines | |
| Name | Lysin |
| Abkürzung | Lys K |
| Restname | Lysyl- |
| essentiell | ja |
| Summenformel | C6H14N2O2 |
| Andere Namen | -- |
| Kurzbeschreibung | weißes Pulver |
| CAS-Nummer | 39665-12-8 |
| Sicherheitshinweise | |
| - keine Gefährdungsklasse - | |
| R- und S-Sätze|| -- | |
| Handhabung | keine besonderen Anforderungen |
| Lagerung | Dicht verschlossen. Trocken. +2 °C bis +8 °C. |
| MAK|| -- ml/m3 | |
| LD50 (Ratte) | -- mg/kg |
| Physikalische Eigenschaften | |
| Aggregatzustand|| fest | |
| Farbe|| farblos | |
| Dichte|| -- g/cm3 | |
| Molmasse|| 164,21 g/mol | |
| Schmelzpunkt|| 225 °C | |
| Siedepunkt|| -- °C | |
| Dampfdruck|| -- hPa | |
| Weitere Eigenschaften | |
| Seitenkette|| basisch | |
| isoelektrischer Punkt|| 9,6 | |
| Löslichkeit|| 300 g/l (in Wasser bei 20 °C) | |
| Gut löslich in | Wasser |
| Schlecht löslich in | |
| Unlöslich in | |
|
SI-Einheiten wurden wo möglich verwendet. Wenn nicht anders vermerkt wurden Normbedingungen benutzt. |
|
| Inhaltsverzeichnis [Verbergen] |
Eigenschaften
Gemeinsam mit Arginin und Histidin gehört Lysin in die Gruppe der basischen Aminosäuren oder Hexonbasen. Diese besitzen eine basische Gruppe, im Fall des Lysin eine freie Aminogruppe in der Seitenkette, durch die sie als Lauge reagieren. Die Ladung des Lysin ist pH-abhängig (pK-Wert: ~ 10).
Vorkommen
Lysin gehört für den Menschen zu den essentiellen Aminosäuren, es kann im Organismus nicht selbst hergestellt werden und muss deshalb mit der Nahrung aufgenommen werden. Dabei benötigt ein erwachsener Mensch etwa 1–1,5 g Lysin pro Tag. Besonders viel Lysin enthält Fisch.
Synthese
Funktionen
Lysin ist einer der Aminosäuren, die bevorzugt postsynthetisch modifiziert werden. Dabei kann die Ladung erhalten bleiben (mono- und di-Methylierung) oder verschwinden (Acetylierung). Im Kollagen wurde ein modifiziertes Lysin gefunden, das Hydroxylysin mit einer OH-Gruppe in der Seitenkette. Dieses erlaubt die nachfolgende O-Glycosylierung in endoplasmatischen Retikulum und Golgi-Apparat und bestimmt damit die Packungsdichte dieses wichtigen Faserproteins.
Beim Abbau des Lysin (Eiweißfäule) entsteht über Pipecolinsäure das Leichengift Kadaverin (Pentamethylendiamin)
Dieser Artikel basiert auf dem Artikel Lysin aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. |