Aminosäure
aus Wikipedia, der freien Enzyklopädie
Aminosäuren sind organische Verbindungen mit einer Carboxylgruppe (–COOH, C-Terminus) und einer Aminogruppe (–NH2, N-Terminus). Die verschiedenen Aminosäuren unterscheiden sich in einer Seitenkette, die auch Aminosäurerest oder kurz Rest genannt wird.
Aminosäuren sind in der Biochemie von großer Bedeutung, da sie die Bausteine von Peptiden und Proteinen (Eiweißen) sind. Im allgemeinen werden in der Literatur 20 sogenannten proteinogene, also in Proteinen vorkommende Aminosäuren, erwähnt, allerdings sind in letzter Zeit 2 weitere hinzugekommen, die manchmal ebenfalls dazugezählt werden (siehe unten: Aminosäuren in Proteinen). Sie sind in der DNA durch je drei Basen verschlüsselt. Es handelt sich dabei stets um α-Aminosäuren, wo die Aminogruppe und die Carboxylgruppe beide mit dem selben Kohlenstoffatom (Cα) verbunden sind. Darüber hinaus gibt es über 150 nicht-proteinogene Aminosäuren, wie etwa Thyroxin, ein Hormon der Schilddrüse.
Aminosäureketten werden in Abhängigkeit von ihrer Länge als Peptide oder Proteine bezeichnet. Bis zu einer Verkettung von etwa 50 Aminosäuren spricht man in der Regel von Peptiden. Die einzelnen Aminosäuren sind dabei innerhalb der Kette über die so genannte Peptidbindung (Säureamid) verknüpft.
Alle Lebewesen stellen Proteine aus Aminosäuren zusammen; die Aminosäuren und ihre Reihenfolge sind in der Desoxyribonukleinsäure (DNA) in Basentripletts (Codons)codiert. Aminosäuren, die ein Organismus nicht selbst herstellen kann, heißen essentielle Aminosäuren und müssen mit der Nahrung aufgenommen werden. Für Menschen sind Valin, Leucin, Isoleucin, Phenylalanin, Tryptophan, Methionin, Threonin und Lysin essentielle Aminosäuren. (Merkspruch: Phenomenale Isolde trüpt metunter Leutnant Valentins lysterne Thräume.) Semi-essentielle Aminosäuren müssen nur in bestimmten Situationen mit der Nahrung aufgenommen werden, z. B. während des Wachstums oder bei schweren Verletzungen. Die übrigen Aminosäuren werden entweder direkt synthetisiert, oder aus anderen Aminosäuren durch Modifikation gewonnen. Für Kinder sind zusätzlich zu den generell essentiellen Aminosäuren auch Cystein (bzw. Cystin) und Tyrosin essentiell, da in diesem Lebensalter die Körperfunktion zu deren Produktion noch nicht ausgereift ist.
Die letzte Entdeckung war das Pyrrolysin, entdeckt in einer Mikrobe, die im Verdauungstrakt von Kühen lebt. Wissenschaftler von der Ohio State University (USA) haben den 22. bislang bekannten im Erbgut kodierten Baustein des Lebens aufgespürt
| Inhaltsverzeichnis [Verbergen] |
Chiralität
Alle Aminosäuren, mit Ausnahme von Glycin, sind chiral gebaut. Sie besitzen ein asymmetrisches Kohlenstoffatom, das als chirales Zentrum wirkt. Daher gibt es stets zwei Enantiomere, die sich wie Bild und Spiegelbild verhalten. Bei chemischen Synthesen entstehen meist Racemate, bei biologischen Systemen aufgrund der Substratspezifität der beteiligten Enzyme dagegen die reinen Enantiomeren. Deshalb findet man bei Lebewesen unter den proteinogenen Aminosäuren ausschließlich nur ein Enantiomer, die L-Form. D-Aminosäuren kommen vereinzelt vor, werden dann aber unabhängig vom proteinogenen Stoffwechsel synthetisiert, z.B. in der bakteriellen Zellwand und kurzen bakteriellen Peptiden wie Valinomycin (siehe Carrier).
Für die Angabe der Chiralität bei Aminosäuren eignet sich besonders die Fischernomenklatur.
Säure- und Basen-Verhalten
Nach Brønsted ist eine Säure ein chemischer Stoff, der Protonen an Reaktionspartner abgeben kann (Protonendonator), eine Base hingegen ein Stoff, der vermittels eines freien Elektronenpaars Protonen aufnehmen kann (Protonenakzeptor). Man beachte, dass bei diesen Vorgängen ein Rollenwechsel stattfindet: Protonenabgabe macht aus einer Säure eine Base, Protonenaufnahme aus einer Base eine Säure.
In wässriger Lösung liegen freie Aminosäuren als Zwitterionen vor, d. h. die Aminogruppe ist protoniert und die Carboxylgruppe ist deprotoniert: H3N+-CHR-COO-. In Proteinen sind allerdings beide Gruppen an der Peptidbindung beteiligt und daher ungeladen.
Eine umso größere Bedeutung hat daher der saure oder basische Charakter der Seitenketten. Die sauren Aminosäuren Asp und Glu sowie die basischen Lys und Arg sind bekannt. Beim pH-Wert der Zelle liegt die protonierte (saure) Form der Aminogruppe H3N+ und die deprotonierte (basische) Form der Carboxylgruppe COO- vor.
Die geladenen Seitenketten beeinflussen zum einen das Löslichkeitsverhalten, sie machen Abschnitte eines Proteins hydrophil, zum anderen spielen sie eine wichtige Rolle bei der Anbindung und Umsetzung des Substrats.
pKS-Werte
Da der pKS-Wert als jener pH-Wert zu sehen ist, bei dem die protonierte bzw. deprotonierte Form zu gleichen Teilen vorliegen, gilt:
- für Asp (pKS = 3,86) bei pH 7: die Seitenkette ist (nahezu) vollständig deprotoniert
- für Lys (pKS = 10,53) bei pH 7: die Seitenkette ist (nahezu) vollständig protoniert.
Bemerkenswert ist die Tatsache, dass die pKS-Werte der Aminosäureseitenketten nach Einbau in ein Protein dramatisch moduliert werden können (Tabelle). Sind diese Seitenketten gar Bestandteil eines aktiven Zentrums, so werden extreme Abweichungen möglich. Beispiele sind:
- Chymotrypsin: enthält am aktiven Zentrum einen Ser-Rest, der (im Rahmen der "katalytischen Triade" aus Asp-102 - His-57 - Ser-195) als Nucleophil (scheinbarer pKS-Wert von 7) reagieren kann;
- Papain: ist am aktiven Zentrum ähnlich aufgebaut, enthält jedoch statt einem Ser- einen Cys-Rest mit analoger Funktion;
- Ribonuklease: hat am aktiven Zentrum in der Tat einen "basischen" Lysin-Rest der (durch Einbau in einen positiv geladenen Käfig) ebenfalls als Nukleophil (pKS ~ 7) agiert;
- Lysozym: enthält in einem nichtpolaren Abschnitt seines aktiven Zentrums eine (protonierte) Aminosäure mit pKS ~ 5.
Tabelle: pKS-Werte von Aminosäure-Seitenketten (für die freie Aminosäuren und nach Einbau in ein Protein)
| Aminosäure | frei | Proteinbestandteil |
|---|---|---|
| Asp | 3,68 | 3,7-4,0 |
| Glu | 4,25 | 4,2-4,5 |
| His | 6,0 | 6,7-7,1 |
| Cys | 8,33 | 8,8-9,1 |
| Tyr | 10,07 | 9,7-10,1 |
| Lys | 10,53 | 9,3-9,5 |
| Arg | 12,48 | - |
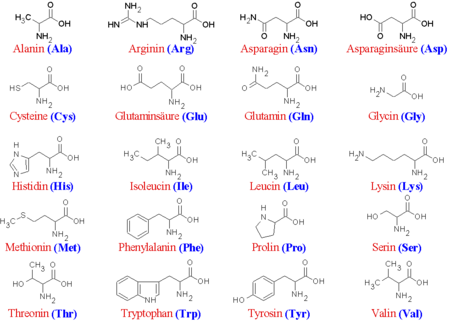
In Proteinen vorkommende Aminosäuren
| L-Alanin | (Ala) | |
| L-Arginin | (Arg) | semi-essentiell |
| L-Asparagin | (Asn) | |
| L-Asparaginsäure | (Asp) | |
| L-Cystein | (Cys) | |
| L-Glutamin | (Gln) | |
| L-Glutaminsäure | (Glu) | |
| Glycin | (Gly) | |
| L-Histidin | (His) | semi-essentiell |
| L-Isoleucin | (Ile) | essentiell |
| L-Leucin | (Leu) | essentiell |
| L-Lysin | (Lys) | essentiell |
| L-Methionin | (Met) | essentiell |
| L-Phenylalanin | (Phe) | essentiell |
| L-Prolin | (Pro) | |
| Pyrrolysin | ||
| L-Selenocystein | (Sec) | |
| L-Serin | (Ser) | |
| L-Threonin | (Thr) | essentiell |
| L-Tryptophan | (Trp) | essentiell |
| L-Tyrosin | (Tyr) | |
| L-Valin | (Val) | essentiell |
siehe auch: Phenylketonurie
| Abkürzung | Voller Name | Seitenkettentyp | Molmasse in g/mol | Isoelektrischer Punkt | Bemerkungen | |
|---|---|---|---|---|---|---|
| A | Ala | Alanin | hydrophob | 89,09 | 6,11 | "Grundtyp" der meisten Aminosäuren |
| C | Cys | Cystein | hydrophil | 121,16 | 5,05 | zwei Cysteine können eine Disulfidbindung ausbilden (um zum Beispiel ein Cystin zu bilden). |
| D | Asp | Asparaginsäure | sauer | 133,10 | 2,85 | - |
| E | Glu | Glutaminsäure | sauer | 147,13 | 3,15 | Reaktionsfolge alpha-Ketoglutarat |
| F | Phe | Phenylalanin | hydrophob | 165,19 | 5,49 | durch Oxidation Reaktion zu Tyrosin |
| G | Gly | Glycin | hydrophil | 75,07 | 6,06 | durch zwei Wasserstoffatome am α-C-Atom ist Glycin nicht optisch aktiv. |
| H | His | Histidin | basisch | 155,16 | 7,60 | pK-Wert im Neutralbereich; ermöglicht Säure/Basen-Katalyse; häufig an enzymatischen Reaktionen beteiligt |
| I | Ile | Isoleucin | hydrophob | 131,17 | 6,05 | zusätzliches Chiralitätszentrum in der Seitenkette |
| K | Lys | Lysin | basisch | 146,19 | 9,60 | - |
| L | Leu | Leucin | hydrophob | 131,17 | 6,01 | - |
| M | Met | Methionin | hydrophob | 149,21 | 5,74 | Methylgruppentransfer der endständigen CH3-Gruppe der Seitenkette durch Thioethergruppe auf andere Moleküle möglich |
| N | Asn | Asparagin | hydrophil | 132,12 | 5,41 | - |
| P | Pro | Prolin | hydrophob | 115,13 | 6,30 | substituierte ?-Aminogruppe (Iminosäure), kann Proteinstrukturen wie alpha-Helices oder beta-Faltblätter unterbrechen. cis- oder trans Konformation in Proteinen. Biosynthese aus Glu über Glu-Semialdehyd, Ringschluss und Reduktion |
| Q | Gln | Glutamin | hydrophil | 146,15 | 5,65 | universeller NH2-Donor im Stoffwechsel |
| R | Arg | Arginin | basisch | 174,20 | 10,76 | Metabolit im Harnstoffzyklus: Spaltung in Orn und Harnstoff. Kann energiereiches N-Phosphat bilden |
| S | Ser | Serin | hydrophil | 105,09 | 5,68 | im Protein phosporylierbar (Kinasesubstrat), besonders kleine polare Seitenkette, häufig im aktiven Zentrum von Proteasen |
| T | Thr | Threonin | hydrophil | 119,12 | 5,60 | zusätzliches Chiralitätszentrum in der Seitenkette, im Protein phosporylierbar (Kinasesubstrat) |
| U | Sec | Selenocystein | hydrophil | 169,06 | - | aktives Zentrum von Selenoenzymen (Glutathion-Peroxidase, Deiodase) |
| V | Val | Valin | hydrophob | 117,15 | 6,00 | - |
| W | Trp | Tryptophan | hydrophob | 204,23 | 5,89 | bestimmt (neben Phe und Tyr) das Absorptionsspektrum von Proteinen |
| Y | Tyr | Tyrosin | hydrophil | 181,19 | 5,64 | im Protein phosporylierbar (Substrat von Tyr-Kinasen) |
| Aminosäure | positive Nettoladung |
negative Nettoladung |
aromatisch | aliphatisch | van-der- Waals-Volumen |
|---|---|---|---|---|---|
| Alanin | - | - | - | X | 67 |
| Cystein | - | - | - | - | 86 |
| Asparaginsäure | - | X | - | - | 91 |
| Glutaminsäure | - | X | - | - | 109 |
| Phenylalanin | - | - | X | - | 135 |
| Glycin | - | - | - | X | 48 |
| Histidin | (X) | - | - | - | 118 |
| Lysin | X | - | - | - | 135 |
| Isoleucin | - | - | - | X | 124 |
| Leucin | - | - | - | X | 124 |
| Methionin | - | - | - | - | 124 |
| Asparagin | - | - | - | - | 96 |
| Prolin | - | - | - | - | 90 |
| Glutamin | - | - | - | - | 114 |
| Arginin | X | - | - | - | 148 |
| Serin | - | - | - | - | 73 |
| Threonin | - | - | - | - | 93 |
| Valin | - | - | - | X | 105 |
| Tryptophan | - | - | X | - | 163 |
| Tyrosin | - | - | X | - | 141 |
Anmerkung:
Der Ladungszustand der positiv oder negativ aufladbaren Aminosäuren hängt vom jeweiligem pH-Wert des umgebenden Milieus ab:
- Ist der pH-Wert kleiner als der Isoelektrische Punkt, dann wird die negative Ladung der negativ aufladbaren Aminosäuren neutralisiert und die positive Ladung der positiv aufladbaren erscheint.
- Ist der pH-Wert größer als der Isoelektrische Punkt, dann wird die positive Ladung der positiv aufladbaren Aminosäuren neutralisiert und die negative Ladung der negativ aufladbaren erscheint.
Siehe auch: Ketosäuren, genetischer Code
Literatur
- Felicitas Reglin: Bausteine des Lebens. Aminosäuren in der orthomolekularen Medizin. Ralf Reglin Verlag, 2004, ISBN 3-930620-43-X
- Uwe Gröber: Orthomolekulare Medizin. Wissenschaftliche Verlagsanstalt mbH Stuttgart, 2002, ISBN 3-8047-1927-9
- Ulrich Strunz: power eiweiß drinks.Heyne, 2003, 3-453-87309-2
- S. J. Freeland, L. D. Hurst: Der raffinierte Code des Lebens, Spektrum der Wissenschaft, S. 86 - 93, Juli 2004.
- Lei Wang, Peter G. Schultz: Die Erweiterung des genetischen Codes. Angewandte Chemie 117(1), S. 34 - 68 (2005), ISSN 0044-8249
Quellen
- SPIEGEL - 24. Mai 2002.
- Bing Hao, Weimin Gong, Tsuneo K. Ferguson, Carey M. James, Joseph A. Krzycki, and Michael K. Chan. A New UAG-Encoded Residue in the structure of a Methanogen Methyltransferase. Science 2002 May 24; 296: 1462-1466
Weblinks
- Aminosäuren (http://www.biologie.uni-hamburg.de/b-online/d16/16j.htm)
- Tagesbedarf unterschiedlicher Personengruppen essentieller Aminosäuren (http://www.acibas.net/Aminosaeuren/index.shtml)
- Amino Acids, FU Berlin (http://www.chemie.fu-berlin.de/chemistry/bio/amino-acids_en.html)
Dieser Artikel basiert auf dem Artikel Aminosäure aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar.